Einleitung
Im Gegensatz zu asiatischen Ländern nimmt die Inzidienz des Magenkarzinoms in Westeuropa eher ab.
Dennoch gehört es mit Rang 5 bei den Männern und Rang 6 bei den Frauen zu den häufigeren Krebserkrankungen. Nicht zuletzt wegen der immer noch unbefriedigenden Gesamtprogonose mit einer 5-Jahresüberlebensrate von 20-30% ist es aber weiterhin einer der häufigsten malginombedingten Todesursachen. Die Therapiestrategie basiert heute auf einem multimodalen Konzept, in dem der Viszeralchirurgie eine entscheidende Rolle zukommt.
In Japan ist die Inzidenz des Magenkarzinoms etwa um den Faktor 5 höher als in der westlichen Welt. Dies hat dazu geführt, dass in Japan sehr gute Screeningprogramme verfügbar sind, die vor allem Frühformen eines Magenkarzinoms sicher entdeckten können. Daher ist auch die Inzidenz der Magenfrühkarzinome in Japan deutliche höher. Hierzulande würde sich ein Screeningprogramm auf Grund der deutlich niedrigeren Inzidenz nicht sinnvoll umsetzen lassen und wird von der S3-Leitlinie auch nicht empfohlen.
Lokalisation
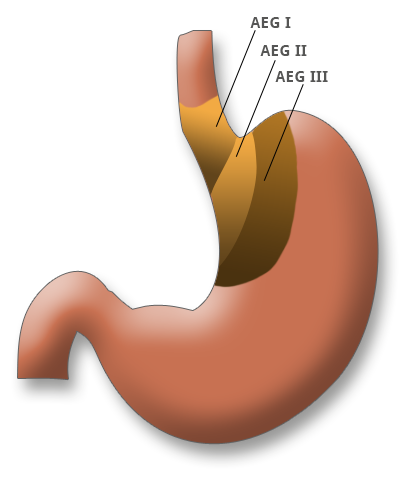
Nach der Lokalisation lassen sich Magenkarzinome des distalen Drittels, des mittleren Drittels und des proximalen Drittels unterscheiden. Letztere zeigen eine steigende Inzidenz, meist sind die Karzinome jedoch im Antrumbereich lokalisiert. Die Adenokarzinome des ösophagogastralen Übergangs werden nach der AEG-Klassifikation in distale Ösophaguskarzinome (AEG I), Kardiakarzinome (AEG II) und subkardiale Karzinome (AEG III) eingeteilt. Dies hat bei der Wahl des Operationsverfahren entscheidende Auswirkung auf das Resektionsausmaß. AEG III-Tumoren erfordern eine Gastrektomie, AEG II-Tumore eine transhiatal erweiterte Gatrektomie und AEG-I-Befunde eine Ösopagusresektion.
Makroskopie
Aufgrund des makroskopischen Eindrucks kann das Magenkarzinom nach der Klassifikation von Borrmann in 4 Typen unterschieden werden, die aber klinisch eine eher untergeordnete Rolle spielen.
Histologie
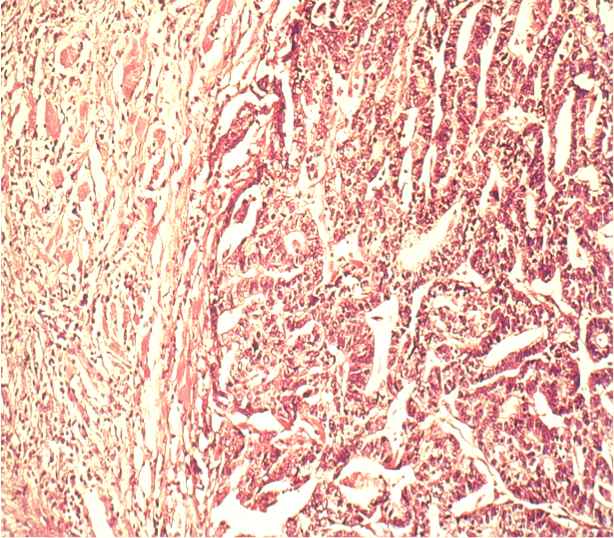
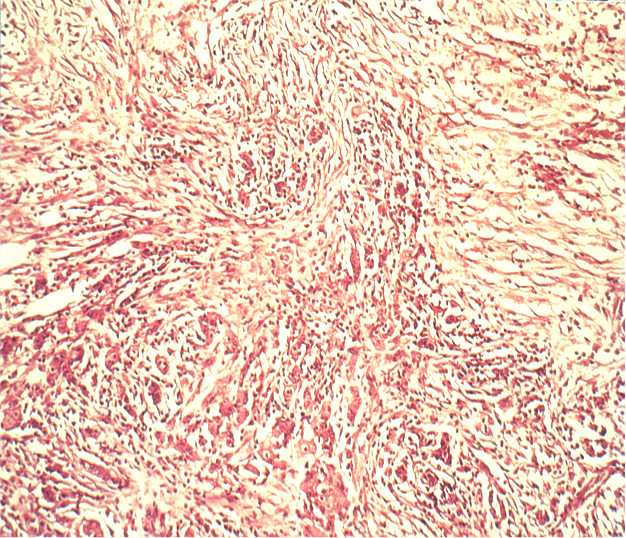
Wichtiger ist die histologische Einteilung der Tumore. Die WHO sieht eine Einteilung in 8 verschiedene Typen vor, wobei die Adenokarzinom den überwiegenden Hauptanteil ausmachen. Die Klassifikation nach Laurén geht auf das Jahr 1965 zurück1. Sie sieht eine Einteilung in die beiden histologischen Haupttypen des Magenkarzinoms vor, den intestinalen Typ und den diffusen Typ
Differenzierung
Schließlich lassen sich Magenkarzinome auch nach der Differenzierzung in 4 Typen einteilen von G1=gut differenziert über G2=mäßig und G3=schlecht bis zu G4=entdifferenziert.
Intestinaler Typ
Der intestinale Typ ist makroskopisch in der Regel gut begrenzt, wächst eher kontinuierlich und zeigt unter dem Mikroskop ein drüsenartig differenziertes Bild, das an intestinale Schleimhaut erinnert. Da diese Form bei bestimmten Altersgruppen und Regionen häufiger vorkommt, wird sie auch epidemische Form genannt.
Diffuser Typ
Da dieser Typ eher von genetischen Faktoren als von den Lebensumständen beeinflusst wird, wird er auch als endemischer Typ bezeichnet. Er ist makroskopisch schlechter abzugrenzen und wächst histologisch diffus mit weit verstreuten Tumorzellen. Durch die diffuse Ausbreitung lässt sich vom makroskopischen Aspekt nicht sicher auf die Tumorränder schließen, daher ist beim diffusen Typ ein größerer Sicherheitsabstand einzuhalten.
Ätiologie
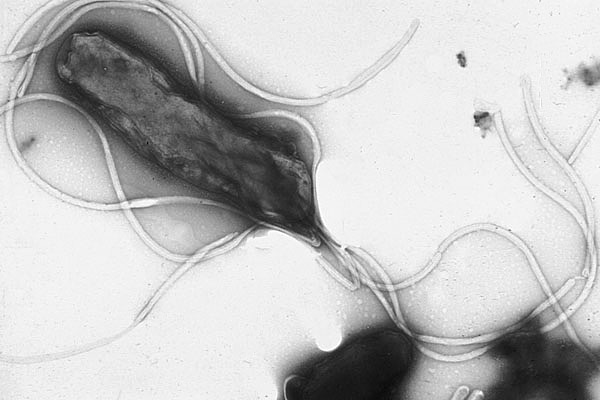
Risikofaktoren für die Entstehung eines Magenkarzinoms sind eine chronische Besiedelung mit Helicobacter pylori, eine chronisch atrophe Gastritis vom Typ A, ein hoher Nitrigehalt in der Nahrung (mit der Magensäure entstehen Nitrosamine), ein Magengeschwür oder ein voroperierter Magen (Magenstumpfkarzinom bei Z.n. BII-Resektion).
Die Vermutung, bestimmte Ernährungsgewohnheiten könnten die Entstehung eines Magenkarzinoms begünstigen, werden durch die Beobachtung japanischer Emigranten unterstützt. Wenn diese westliche Ernährungsgewohnheiten annehmen, sinkt die Inzidenz drastisch ab. Bleiben sie allerdings auch in ihrer neuen Heimat beim gewohnten Ernährungsstil, bleibt die Inzidenz unverändert hoch. Eine seltene Präkanzerose stellt der Morbus Ménétrier da, eine sog. Riesenfaltengastritis, bei der häufig eine begleitende Besiedlung mit HP zu finden ist und die in 10% der Fälle zum Magenkarzinom fortschreitet.
Symptomatik
Das völlige Fehlen von Frühsymptomen macht ein rechtzeitiges Erkennen eines Magenkarzinoms enorm schwer. Frühe Formen sind daher die Ausnahme und meist Zufallsbefunde. Unspezifische Oberbauchschmerzen sollten daher differentialdiagnostisch auch immer mittels Endoskopie abgeklärt werden, die eine hohe Sensitivität für das Erkennen eines Magenkarzinoms aufweist. Patienten mit einem oder mehreren der folgenden Alarmsymptome im klinischen Zusammenhang mit einem V. a. Ösophagus- oder Magenkarzinom sollten zu einer frühzeitigen Endoskopie mit Entnahme von Biopsien überwiesen werden:
- Dysphagie
- rezidivierendes Erbrechen
- Inappetenz
- Gewichtsverlust
- Gastrointestinale Blutung
AEG-Klassifikation
Die Adenokarzinome des ösophagogastralen Übergangs werden nach der AEG-Klassifikation in distale Ösophaguskarzinome (AEG I), Kardiakarzinome (AEG II) und subkardiale Karzinome (AEG III) eingeteilt. Dies hat bei der Wahl des Operationsverfahren entscheidende Auswirkung auf das Resektionsausmaß. AEG III-Tumoren erfordern eine Gastrektomie, AEG II-Tumore eine transhiatal erweiterte Gatrektomie und AEG-I-Befunde eine Ösopagusresektion.
Diagnostik
Endoskopie
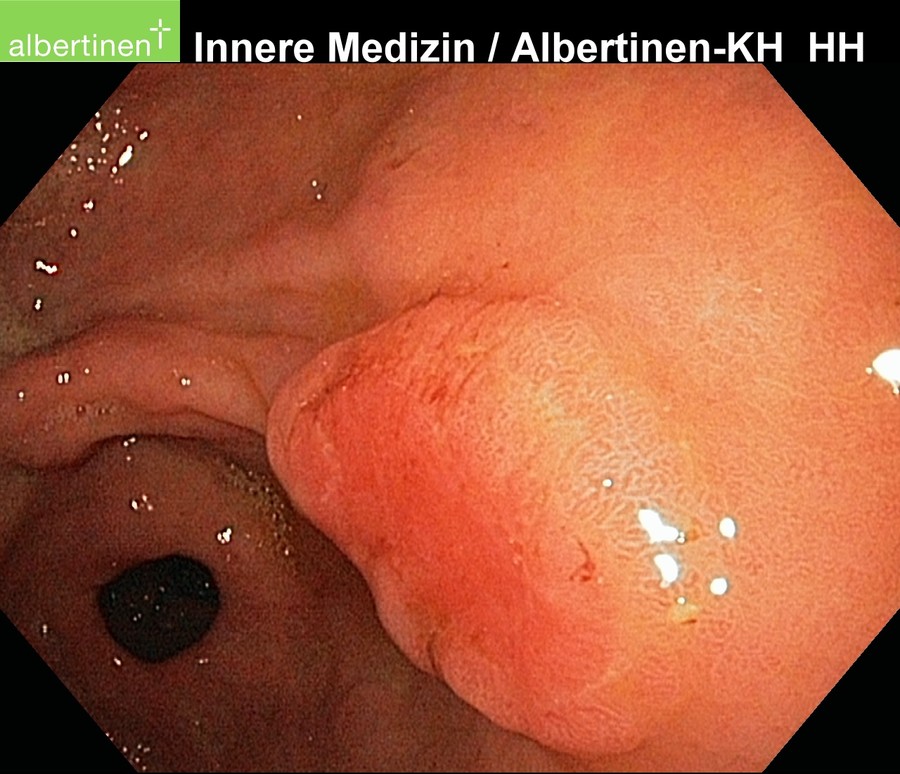
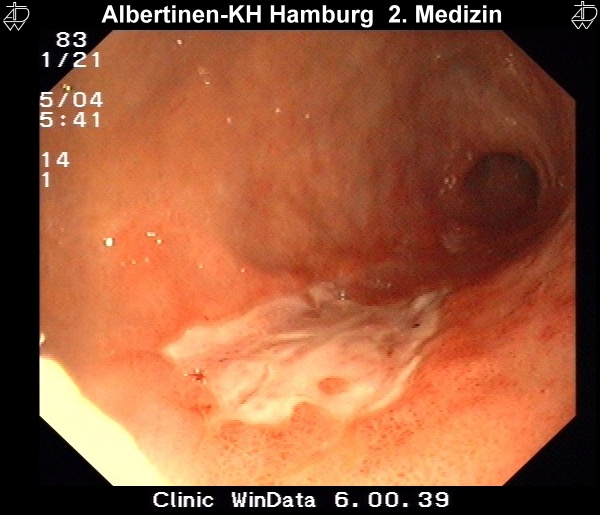
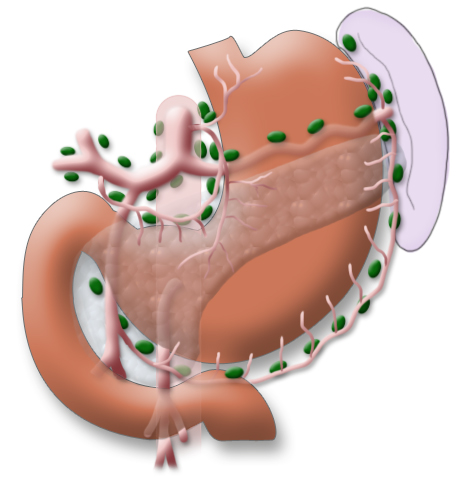
Die Untersuchungsmethode der Wahl ist die Endoskopie. Sie erlaubt eine makroskopische und histologische Diagnosestellung sowie eine sichere Lokalisation des Befundes. Durch die Ergänzung durch die endoskopische Ultraschalluntersuchung kann eine lokale Ausbreitungsdiagnostik erfolgen. Schwerer zu beurteilen ist in der Endosonografie die regionale Lymphknotenmetastasierung.
Alle Bilder mit freundlicher Genehmigung vom Albertinen-Krankenhaus in HamburgSonografie
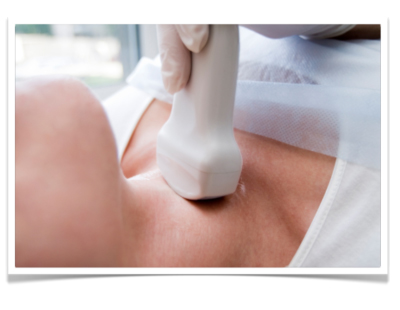
Die perkutane Sonografie des Halses kann beim Magenkarzinom bei klinischem Verdacht auf eine Lymphknotenmetastasierung erfolgen und sollte bei AEG-Tumoren ergänzend zum Staging eingesetzt werden. An der Einmündung des ductus thoracicus in die Vena subclavia kann eine Lymphknotenmetastasierung vorliegen, man spricht vom sog. Virchow-Lymphknoten.
Staging
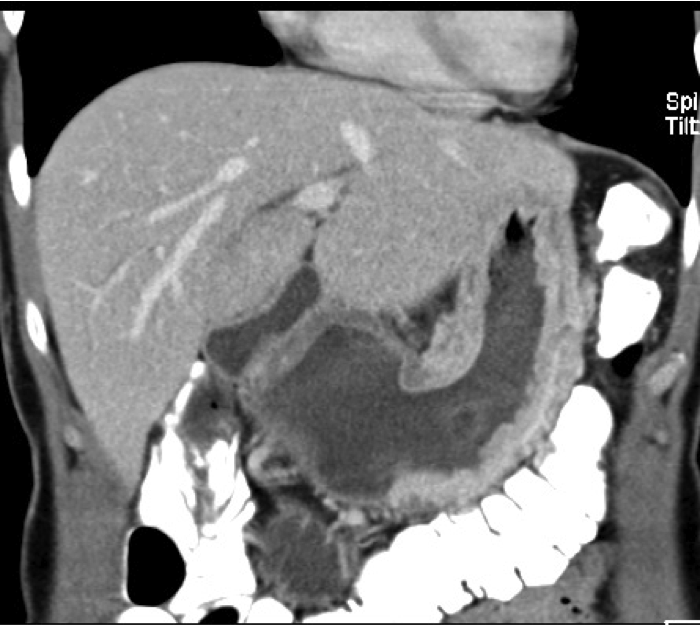
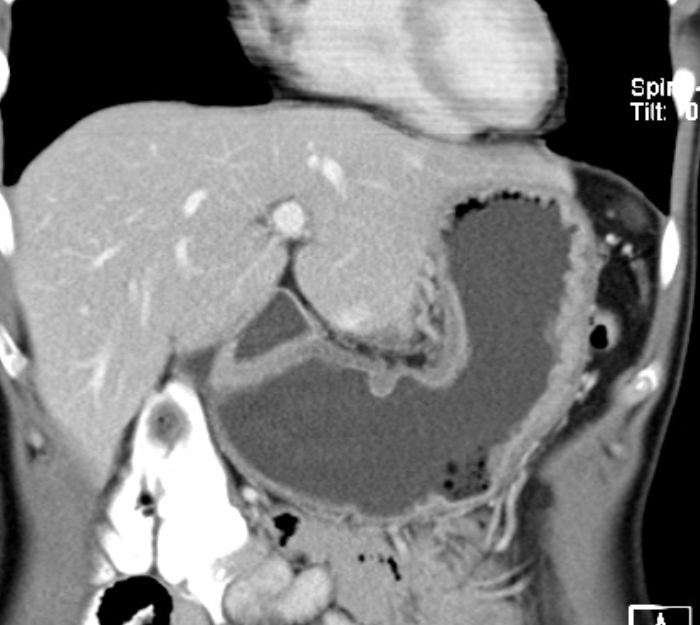
Zur Ausbreitungsdiagnostik beim Magenkarzinom gehört neben der Endoskopie mit Biopsie eine Schnittbildgebung des Thorax und des Abdomens. In einer Computertomografie können Fernmetastasen detektiert oder ausgeschlossen werden. Die Endosonografie ist geeignet, um die Eindringtiefe des Tumors in die Wandschichten des Magens zu beurteilen. Auch mögliche Lymphknotenmetastasen können so erkannt werden.
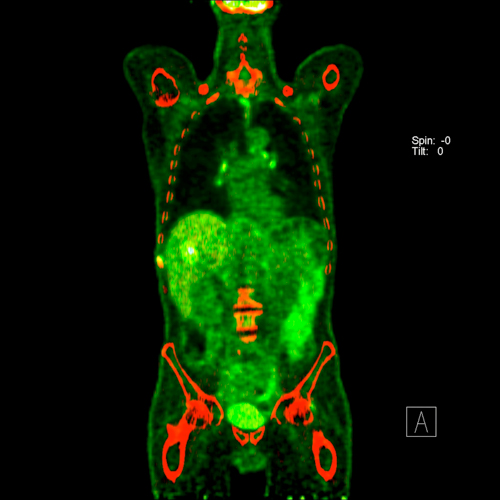
In Einzelfällen kann eine PET-Untersuchung helfen, fragliche Raumforderungen beispielsweise in der Leber auf das Vorliegen einer Metastasierung abzuklären.
Staging-Laparoskopie
Die Metastasierung eines Magenkarzinoms kann neben hämatogenen und lymphogenen Wegen auch per continuitatem als Pertitonealkarzinose auftreten. Diese ist auf CT-Bildern nur schwer zu erkennen, insbesondere wenn sie noch in begrenztem Ausmaß vorliegt. Für das therapeutische Vorgehen hat das Vorliegen einer Peritonealkarzinose aber eine entscheidende Bedeutung. Eine kurative Resektion ist dann in der Regel nicht mehr möglich und dem Patienten kann in aller Regel eine Laparotomie erspart werden.
Palliative Resektion sollten beim Magenkarzinom nicht durchgeführt werden, es sei denn, eine therapierefraktäre Obstruktion oder Blutung zwingt dazu. Um eine Peritonealkarzinose vor einer Gastrektomie auszuschließen, kann eine Staging-Laparoskopie durchgeführt werden. Hierbei lassen sich auch eventuell zuvor übersehene Lebermetastasen entdecken und eine Spülzytologie entnehmen. Falls hier maligne Zellen gefunden werden, korreliert das mit einer schlechteren Prognose, ändert aber nicht das therapeutische Vorgehen.
Eine vorliegende Peritonealcarcinose kann beim Magenkarzinom unter Umständen mit einer intraoperativ durchgeführten hyperthermen intraabdominellen Chemoperfusion kombiniert werden (HIPEC). In Rahmen von Studien wird in dieser Situation auch ein neoadjuvanter Ansatz mit intraperitonealer Chemotherapie untersucht.
Es gibt keine Evidenz für einen Nutzen der Bestimmung von Tumormarkern. Viele verschiedene Studien untersuchten die Bedeutung verschiedener Marker, von den bekannten Markern CEA, Ca19 – 9 und Ca72 – 4 bis hin zu neueren Markern, die auch Hinweise auf den Tumormetabolismus oder pathophysiologische Veränderungen des Magens im Rahmen der Karzinogenese (Pepsinogen) erlauben sollten. Für alle diese Marker muss festgestellt werden, dass die berichtete Sensitivität und Spezifität für die Primärdiagnostik nicht ausreicht, sie sind daher als Screening oder Staging-Mittel ungeeignet.
Breischluck-Untersuchungen sind für das Staging von Tumoren des Magens oder ösophagogastralen Übergangs nicht geeignet. Die Fragen der Höhenlokalisation des Tumors kann durch Endoskopie und CT-Rekonstruktionstechniken hinreichend beantwortet werden.
Interessieren Sie sich für die aktuellen Diagnostik- und Therapiestandards beim Magenkarzinoms? Dann lesen Sie doch mal die S3-Leitlinie.
Therapie
Der entscheidende Schritt in der Behandlung des Magenkarzinoms, der die Gesamtprognose am stärksten beeinflusst, ist die chirurgische Therapie. Das Ziel ist immer, eine RO-Resektion zu erreichen, also eine Resektion makroskopisch und mikroskopisch im Gesunden, ohne dass Tumorreste im Körper verbleiben.
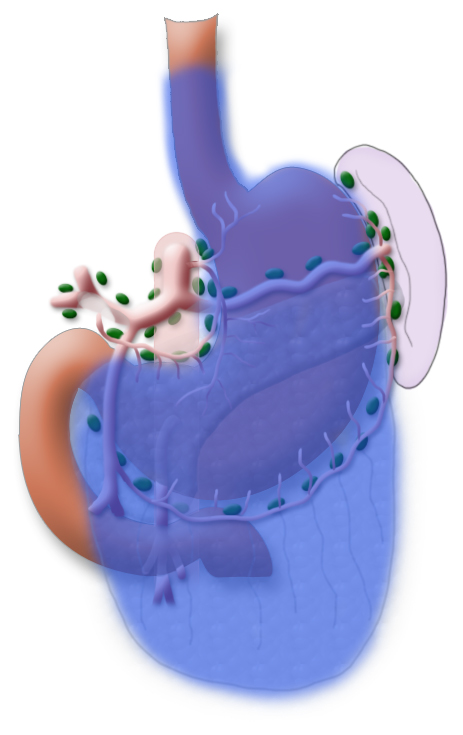
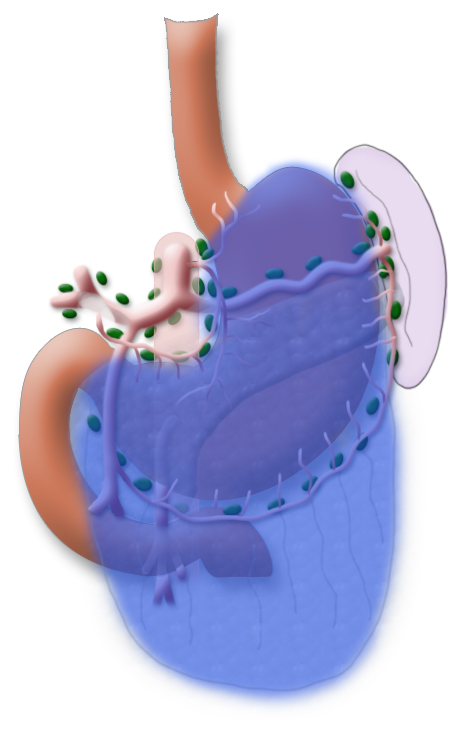
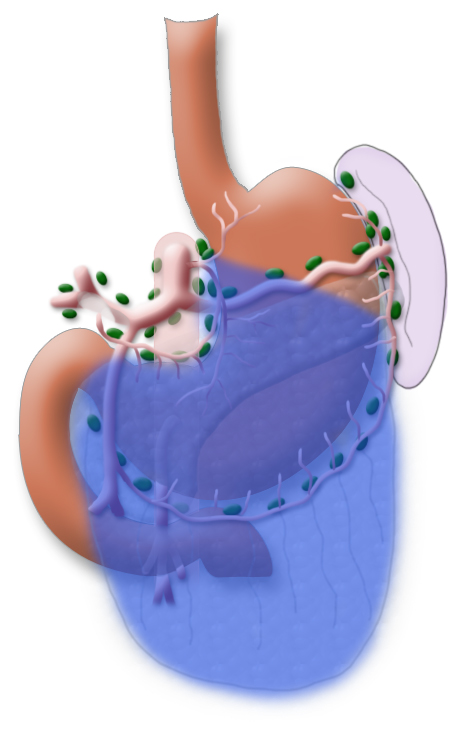
Ergänzt wird die Gastrektomie durch eine Entfernung aller Lymphknoten, die den Magen direkt umgeben (D1-Segment) und den Lymphknoten entlang des Truncus coeliacus, der A. hepatica und der A. lienalis (D2-Segment).
In Japan wird standardmäßig eine erweiterte Lymphadenektomie durchgeführt, die das Kompartiment DIII unfasst. Dies wird durch die Tatsache begünstigt, dass bei asiatischen Patienten das viscerale Fett nicht so ausgeprägt ist. Dadurch wird dieser Schritt technisch einfacher.
Eine Metastasierung in die paraaortalen und mesenterialen Lymphknoten (D3-Segment) wird als Fernmetastasierung gewertet, eine Mitresektion dieser Lymphknoten bietet für die Patienten keinen Vorteil im Gesamtüberleben, erhöht aber die Morbidität des Eingriffs.
Risikobewertung
Voraussetzung für eine erfolgreiche Operation ist neben der Resektabilität des Tumors auch die Operabilität des Patienten, also die funktionelle Operabilität. Patienten mit einem Magenkarzinom sind nicht selten unter- bzw. fehlernährt, was entscheidenden Einfluss auf das postoperative Outcome und die Entwicklung beispielsweise einer Anastomoseninsuffizienz hat. Auch die generelle Leistungsfähigkeit und die Komorbiditäten eines Patienten müssen dabei berücksichtigt werden.
Multimodale Therapiekonzepte
Bei lokal fortgeschrittenen Tumoren (uT3/uT4) kann eine neoadjuvante Chemotherapie eine Tumorverkleinerung im Sinne eines „Downsizing“ und „Downstaging“ erreichen und die Chanchen auf eine R0-Resektion erhöhen.
Üblicherweise wird nach Abschluss einer solchen vorgeschalteten Chemotherapie eine Re-staging-Untersuchung durchgeführt, die das Ansprechen des Tumors auf die Behandlung zeigen kann. Auch bei gutem Ansprechen ist die nachfolgende Resektion obligat, da der seltene Fall einer complete response nur am vollständigen Präparat histologisch durch den Pathologen beurteilt werden kann.
Chirurgische Resektion
Die Lokalisation und der histologische Typ nach Laurén haben Einfluss auf die Wahl des Operationsverfahren. AEG-II-Tumoren der Kardia werden transhiatal erweitert operiert, wobei der komplette Magen und eine distale Ösophagusmanschette reseziert wird.
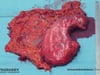
Beim eigentlichen Magenkarzinom wird standardmäßig eine Gastrektomie durchgeführt. Nur bei intestinalen Tumoren, die sehr weit distal liegen kann unter Berücksichtigung eines ausreichenden Sicherheitsabstand eine subtotale oder 4/5 Magenresektion durchgeführt werden. Einen Einfluss auf das Gesamtüberleben hat dies nicht, die Lebensqualität ist aber nach einer subtotalen Mangenresektion deutlich besser.2
Obligater Bestandteil jeder Gastrektomie beim Magenkarzinom ist eine Omentektomie, also Entfernung des großen Netzes, welches seinen entwicklungsgeschichtlichen Ursprung ja am Magen hat. Auch eine Bursektomie wird durchgeführt, die Resektion der Bursa omentalis auf der Pankreasoberfläche.
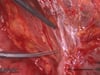
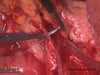
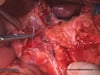
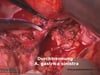
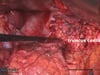
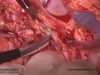
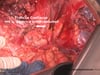
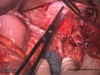
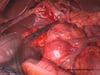
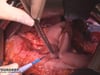
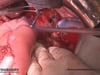
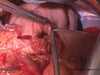
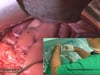
OP-Video Gastrektomie
Sehen Sie hier eine komplette Operation in Einzelschritten. Dargestellt ist eine onkologische Gastrektomie mit Omentektomie, Bursektomie, systematischer DII-Lymphadenektomie, simultaner Cholezystektomie sowie Rekonstruktion der Passage als terminolaterale Ösophagojejunostomie mit Herfarth-Lawrence-Rondino Pouch.
1 Lagerung & Übersicht
Vorbereitungen zur Gastrektomie, Lagerung des Patienten
2 Zugang
Zugang zur Abdominalhöhle
- Der Zugang erfolg über eine Oberbauchquerlaparotomie, der Übersichtlichkeit halber sind die Rippenbögen auf der Haut mit einem Stift markiert worden.
- Als nächstes wird die vordere Rektusscheide eröffnet
- Nun werden beide Bäuche des M. rectus abdominis durchtrennt
- Nach Eröffnung des Peritoneums lokalisiert der Operateur das Ligamentum teres hepatis und durchtrennt dieses zwischen zwei Overholtklemmen. Dies wird deshalb gemacht, weil bei Vorliegen einer portalen Hypertension die eigentlich obliterierten Gefäße in diesem Ligament wieder eröffnet sein können.
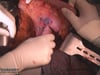
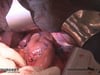
3 Exploration
Exploration des Situs, Darstellen des Tumors, Ausschluss einer Peritonealcarcinose
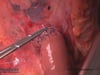
4 Omentektomie Teil 1
Beginn der Omentektomie
5 Lig. hepatoduodenale
Präparation des Lig. hepatoduodenale und Absetzen der A. gastrica dextra
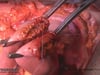
6 Omentekomie Teil 2 und Bursektomie
Komplettierung der Omentektomie und Resektion der Bursa omentalis
7 Präparation der A. gastroomentalis dextra
- Die linke gastroepiploische Gefäßarkade wird präpariert, zunächst wird die Vene, danach die Arterie unterbunden
8 Absetzen am Duodenum
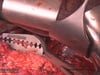
- Das Duodenmu wird unmittelbar postpylorisch mit einem Linearstapler durchtrennt.
- Der Duodenalstumpf wird sorgfältig invertierend übernäht, um eine Duodenalstumpfinsuffizienz zu verhindern. Dies ist eine gefürchtete Komplikation, da hierüber Galle- und Pankreassekret in die Bauchhöhle austreten kann
9 Lymphadenektomie Truncus coeliacus, Durchtrennen der A. gastrica sinistra
- Die Lymphadenektomie wird entlang der A. hepatica communis fortgeführt
- Die Vena coronaria ventriculi wird ligiert
- Die A. lienalis wird freigelegt, die A. gastrica sinistra wird logiert und durchtrennt
- Nun hat man freie Sicht auf den Truncus coeliacus und die Aorta
10 Anatomische Darstellung nach Präparation im Bereich des Truncus coeliacus
- Der gesamte Verlauf der A. hepatica communis ist freipräpariert
- Die Lymphadenektomie im Bereich der Leberpforte und des Pankreasoberrandes ist abgeschlossen
- Der Truncus coeliacus liegt frei
- Entlang der A. lienalis erfolgt die weitere Lymphadenektomie
11 Präparation der Aa. gastricae breves, Fortsetzung der Lymphadenektomie
- Entlang der großen Kurvater wird das Omentum maus abgelöst
- Die Lymphadenektomie entlang der A. lienalis wird bis zum Milzhilus fortgeführt. Das Pankreas wird dabei geschont
- Die Aa. gastricae breves werden durchtrennt
12 Anatomische Darstellung nach Präparation der Aa. gastricae breves
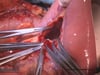
13 Präparation am hiatus oesophageus
- Um das Resektat am distalen Ösophagus absetzen zu können, muss der Hiatus oesophageus freipräpariert werden
- Der peritoneale Überzug an beiden Zwerchfellschenkeln wird inzidiert
- Der N. vagus wird dargestellt und mit der elektrischen Schere durchtrennt
- Letztlich wird der distale Ösophagus zirkulär komplett freipräpariert
14 Resektion, Darstellung des Präparates
- Um später die Ösophagojejunostomie zur Rekonstruktion der Passage zu ermöglichen, muss ein Zirkularstaplerkopf in die distale Speiseröhre eingebracht werden
- Um diesen zu fixieren, wird mit einer Tabaksbeutelnahtklemme eine Tabaksbeutelnaht vorgelegt
- Zum Resektat hin wird eine Klemme gesetzt, damit kein Mageninhalt austreten kann, dann wird das Resektat mit der Schere abgesetzt
- Das Resektat umfasst den kompletten Magen sowie das Omentum majus und das Lymphadenektomiepräparat
15 Anastomose Teil 1
- Die Tabaksbeutelnahtklemme wird entfernt
- der Ösophagus wird vorgedehnt, dann wird der Kopf eines 25mm Zirkularstaplers im Ösophagus platziert und die Tabaksbeutelnaht geknüpft
- Der obere Teil der Anastomose ist nun vorbereitet
16 Vorbereitung der Rekonstruktion
- Zur Rekonstruktion der Passage wird eine Jejunalschline verwendet
- Das Mesenterium wird präpariert und unter Belassen der zentralen Gefäßarkade skelettiert
- Der Darm wird mit einem Linearstapler durchtrennt
17 Mesokolischer Hochzug der alimentieren Schlinge
- Um die Dünndarmschlinge zur Rekonstruktion hochzuziehen, wird transmesokolisch eine Durchtrittspforte geschaffen
18 Simultane Cholecystektomie
- Im Rahmen einer Gastrektomie sollte eine simultane Cholezystektomie erfolgen
- Dies erfolgt nicht aus onkologischen Kriterien, sondern um spätere Komplikationen durch Gallensteine zu vermeiden. Zum Einen ist die Entstehung von Gallensteinen nach eine Gastrektomie wahrscheinlicher, zum Anderen kann nach einer Gastrektomie keine ERCP mehr durchgeführt werden, wenn sich Gallensteine im Gallengang festgesetzt haben sollten
- Die Morbidität der Operation wird durch eine simultane Cholezystektomie nicht erhöht
19 Pouchbildung
- Ist man gezwungen, die Anastomose im Thorax anzulegen, ist nicht ausreichend Platz vorhanden für die Bildung eines Pouches
- Der Pouch besteht aus eine Duplikatur des Dünndarms, die mittels Stapler zu einem Lumen vereinigt wird
- Anschließend wird eine Jejunoplicatio um den Pouch herum angelegt, somit kann ein gewisser Schutz gegen Reflux erreicht werden.
20 Ösophago-Jejunostomie
- Die Ösophagojejunostomie wird mit einem 25mm Zirkularstapler angelegt
- Das Gerät wird über den Pouch eingeführt und der Zentraldorn durch die Wand des Dünndarms ausgestochen
- Dann wird der Stadler mit dem in den Ösophagus eingeknüpften Kopf verbunden und die Anastomose ausgelöst
- Es ergeben sich zwei Anastomosenringe, der proximale wird in der Regel ebenfalls zur histologischen Sicherung eingeschickt, da er den am weitesten oral gelegenen Resektatrand repräsentiert
21 Pouch schliessen
- Nach Entfernen des Zirkularstaplers wird der Pouch vernäht
22 Kontrolle auf Dichtigkeit
- Um die primäre Dichtigkeit der Anastomose zu überprüfen, wird vom Anästhesisten eine Magensonde vorgeschoben
- Diese wird im Pouch platziert, der abführende Dünndarm zugeklemmt und der Pouch mit einer Methylenblau-Kochsalz-Lösung gefüllt
23 Manschettenanlage
- Diese Jejunoplicatio wird zentral mit nicht resorbierbarem Nahtmaterial geschlossen, somit ist gleichzeitig die Anastomose geschützt
24 Fixieren der alimentieren Schlinge
- Um ein Verrutschen der alimentieren Schlinge zu verhindern, wird sie mit resorbierbarem Nahtmaterial an der Durchtrittstelle durch das Mesokolon fixiert
25 Jejuno-Jejunostomie
- Zur Rekonstruktion gehört auch eine Y-Roux-Fußpunktanastomose
- Hier trifft die biliopankreatische Schlinge auf die alimentäre, also Galle- und Pankreasflüssigkeit auf Nahrungsbrei
- Die Anastomose erfolgt End-zu-Seit in Handnahttechnik
26 Verschluss des Mesoschlitzes
Um eine innere Hernie zu vermeiden, wird der entstandene Mesoschlitz fortlaufend mit einem resorbierbaren Faden verschlossen.
27 Abschluss der OP
Die Platzierung von Drainagen beendet den Eingriff. Eine Robinsondrainage wird an der Anastomose platziert, die andere im Bereich des Duodenalstumpfes. Anschließend wird die Bauchdecke schichtgerecht verschlossen
Lymphadenektomie
Eine systematische DII-Lymphadenektomie umfasst die Mitentfernung aller perigastrischen Lymphknoten und die Lymphknoten um den Truncus coeliacus, die A. hepatica und die A. lienalis. In der Regel können dabei mehr als 25 Lymphknoten entfernt und histologisch untersucht werden. Um im abschließenden Tumorstaging die Angabe „pN0“ machen zu können, sollten mindestens 16 regionäre Lymphknoten untersucht und als tumorfrei klassifizier worden sein. Die Splenektomie gehört standardmäßig nicht zum Resektionsumfang.3
Rekonstruktion
Die Rekonstruktion der Nahrungspassage erfolgt durch Hochzug einer Dünndarmschlinge. Eine bessere Schluckfunktion und Lebensqualität erfahren Patienten, wenn man eine Dopplung der Dünndarmschlinge anlegt, einen sog. Pouch. Intrathorakal ist die Anlage eines Pouches jedoch nicht durchführbar, so dass dieses Verfahren bei AEG-II-Tumoren nicht zur Verfügung steht. Sollte der Patient funktionell nicht operabel sein, ist die Durchführung einer definitiven Radiochemotherpie in potientiell kurativer Absicht möglich, ansonsten ist die perioperative Chemotherapie, also vor und nach der Operation das Standardvorgehen für fortgeschritte Tumoren. Eine präoperative Radiochemotherapie hat keinen Stellenwert in der Therapie des Magenkarzinoms.
Magenfrühkarzinom
Beim Magenfrühkarzinom wird nur die Mukosa bzw. Submukosa infiltriert. Die Japanische Klassifikation unterscheidet dabei einen erhabenen, flachen oder eingesenkten Typ. Aufgrund der ausgeprägten lymphatischen Versorgung der Submukosa steigt bei einem Fortschreiten der Infiltration von der Mukosa in die Submukosa die Wahrscheinlichkeit für das Vorliegen von Lymphknotenmetastasen von 4-5% auf 22%. Ein Magenfrühkarzinom kann mittels endoskopischer Resektion behandelt werden, wenn es folgende Kriterien erfüllt:
- Läsionen von <2 cm beim erhabenen Typ
- Läsionen von <1cm beim flachen Typ
- Keine makroskopische Ulzeration
- Histologischer Differenzierungsgrad gut oder mäßig (G1/G2)
- Invasion begrenzt auf die Mukosa
Diese Resektion sollte an einem Zentrum mit viel Erfahrung bei dieser Behandlung durchgeführt werden. Die Resektion sollte dabei als En-bloc-Resektion erfolgen, die eine komplette histologische Beurteilung auch der Ränder des Befundes erlaubt.

 Wunde, Wundheilung
Wunde, Wundheilung Infektion
Infektion Akutes Abdomen
Akutes Abdomen Abdominaltrauma
Abdominaltrauma Ileus
Ileus Hernien
Hernien Struma benigna
Struma benigna Schilddrüsen-CA
Schilddrüsen-CA Nebenschilddrüsen
Nebenschilddrüsen Hypderthyreose
Hypderthyreose Nebenniere
Nebenniere Achalasie
Achalasie Ösophagus-CA
Ösophagus-CA Ösophagusdivertikel
Ösophagusdivertikel Ösophagusperforation
Ösophagusperforation Verätzung
Verätzung Magen-CA
Magen-CA Ulkuskrankheit
Ulkuskrankheit GERD
GERD Adipositas
Adipositas CED
CED Divertikulitis
Divertikulitis Kolon-CA
Kolon-CA Proktologie
Proktologie Rektum-CA
Rektum-CA Aantomie
Aantomie Ikterus
Ikterus Cholezystolithiais
Cholezystolithiais Benigne Leberläsionen
Benigne Leberläsionen Maligne Leberläsionen
Maligne Leberläsionen Pankreatitis
Pankreatitis Pankreaskarzinom
Pankreaskarzinom