Carotisstenose
Zirka 80% aller Schlaganfälle sind ischämisch bedingt. Wenn auch der überwiegende Anteil davon kardioembolischer Genese ist, so sind ca. 20% mit einer Stenose der Carotiden assoziiert (arterio-arterielle Embolie/plaqueembolisch oder Abschwemmen von Thromben). Insgesamt kann von ca. 30.000 Carotis-assoziierten Schlaganfällen pro Jahr in Deutschland ausgegangen werden.
Es wird zwischen asymptomatischen und symptomatischen Carotisstenosen unterschieden.
Die asymptomatische Stenose (Stadium I) hat in den letzten sechs Monaten nichtzu einer neurologischen Symptomatik geführt und wird oft im Rahmen der Abklärung einer peripheren arteriellen Verschlusskrankheit (pAVK) oder einer kardialen Erkrankung als Zufallsbefund entdeckt. Ein routinemäßiges Screening ist bislang nicht empfohlen, es empfiehlt sich, kardiovaskuläre Risikogruppen auf Vorliegen einer Carotisstenose zu untersuchen.
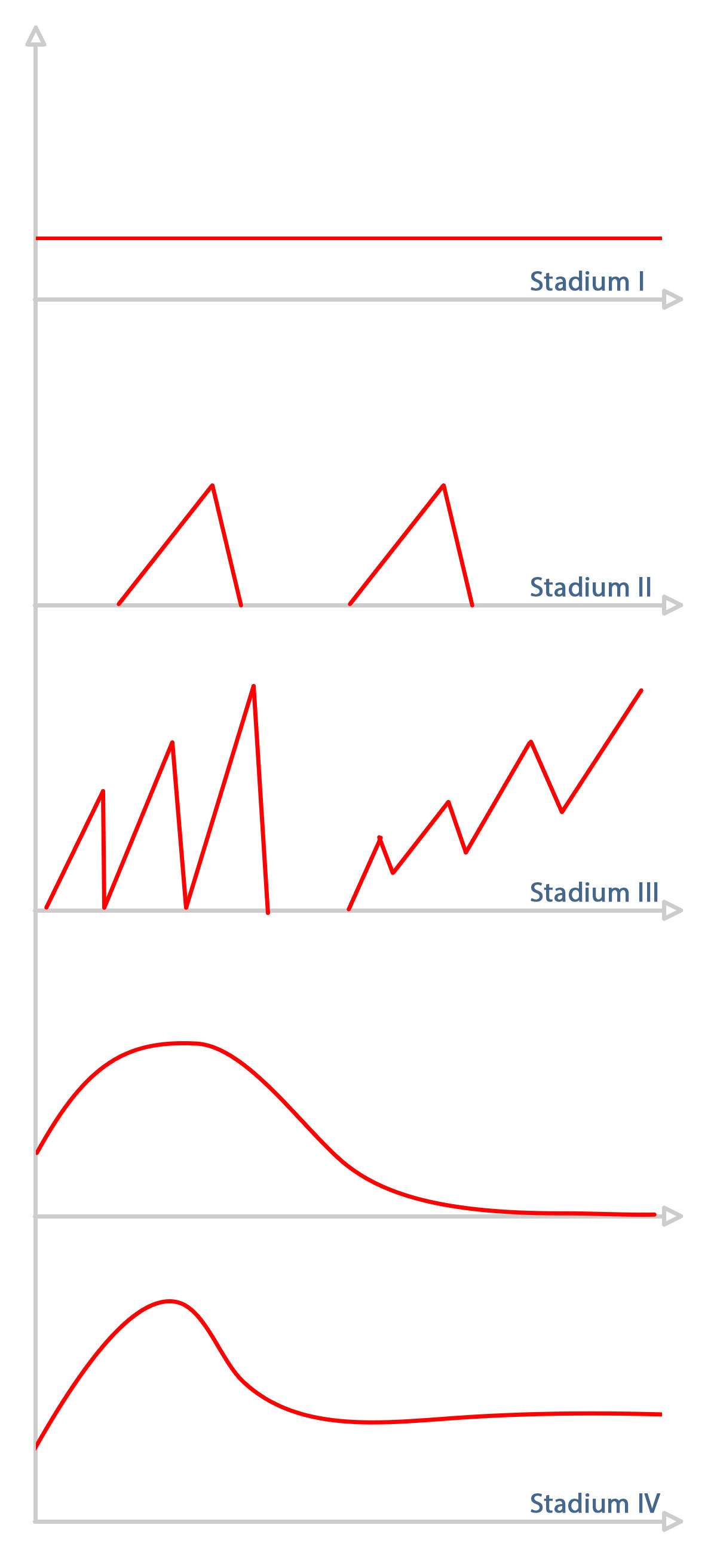
Bei der symptomatischen Carotisstenose liegt eine neurologische Symptomatik vor. Hierunter fallen die Stadien II-IV (siehe Abbildung 1).
Im Stadium II liegt eine reversible Ischämiesymptomatik vor. So führt eine Embolie in das Stromgebiet der A. ophthalmica zur kurzfristigen, reversiblen, einseitigen Erblindung, der sogenannten „Amaurosis fugax“. Im Rahmen einer transitorisch ischämischen Attacke (TIA) liegt eine reversible Hemiparese/-plegie, Aphasie und/oder Dysarthriesymptomatik vor.
Zum Stadium III zählen die Crescendo-TIA (wiederholte TIA-Symptomatik in immer kürzer werdenden Zeitintervallen) als Schlaganfall-Vorbote, der sich progredient entwickelnde Schlaganfall („stroke-in-evolution“) und der bereits manifeste Schlaganfall („completed stroke“).
Zum Stadium IV zählen alle Patienten mit bereits erlittenem carotis-bedingtem Schlaganfall. Die modifizierte Rankin-Skala beschreibt hier das Ausmass des neurologischen Defizits.
Stadieneinteilung der Carotisstenose
| Stadium I | Asymptomatische Stenose |
|---|---|
| Stadium IA | Ohne hochgradige kontralaterale Stenose/ Verschluss |
| Stadium IB | Mit hochgradiger kontralaterale Stenose/ Verschluss |
| Stadium II | Reversible zerebrale Ischämie < 6 Monate |
| Stadium IIA | Amaurosis fugax |
| Stadium IIB | TIA (Symptome < 24h) |
| Stadium III | Indikationen zur Notfall-Carotis-TEA |
| Stadium IIIA | Crescendo-TIA |
| Stadium IIIB | Akuter/ protrahierter Schlaganfall |
| Stadium IV | Ipsilateraler Schlaganfall < 6 Monate |
| Rankin 0 | Kein Defizit nachweisbar |
| Rankin 1 | Minimales, funktionell nicht beeinträchtigendes Defizit |
| Rankin 2 | Leichter Schlaganfall, tägliche Verrichtungen möglich |
| Rankin 3 | Mittelschwerer Schlaganfall, Gehen alleine möglich |
| Rankin 4 | Schwerer Schlaganfall, Gehen nur mit Hilfe möglich |
Zeitlicher Verlauf der Symptome
Diagnostik
Den größten Stellenwert bei der Diagnostik der Carotisstenose nimmt die farbkodierte Duplexsonographie (FKDS) ein. Mit ihr können anhand von Flussgeschwindigkeitsmessungen und Flussprofilen in der Carotisstrombahn Rückschlüsse auf den sogenannten „Stenosegrad in % nach NASCET-Kriterien“ gezogen werden. Zudem kann die Plaquemorphologie beurteilt werden (z.B. exulceriert, echoarm / weich oder echoreich / hart). Die Klassifizierung in Stenosegrade erfolgt aktuell gemäß den DEGUM-Empfehlungen (Deutsche Gesellschaft für Ultraschall in der Medizin) nach den sogenannten NASCET-Kriterien (North American Symptomatic Carotid Endarteriectomy Trial).
Ergänzt werden kann die Diagnostik um eine CT- oder MR-Angiographie der supraaortalen Gefäße, wichtig zum Beispiel auch zur Beurteilung von komplizierten Gefäßverläufen (Kinking oder Coiling) oder zur Beurteilung der intrakraniellen Gefäßabschnitte. Eine mögliche cerebrale Ischämie sollte mittels initialem CCT und MRT mit Diffusionswichtung abgeklärt werden.
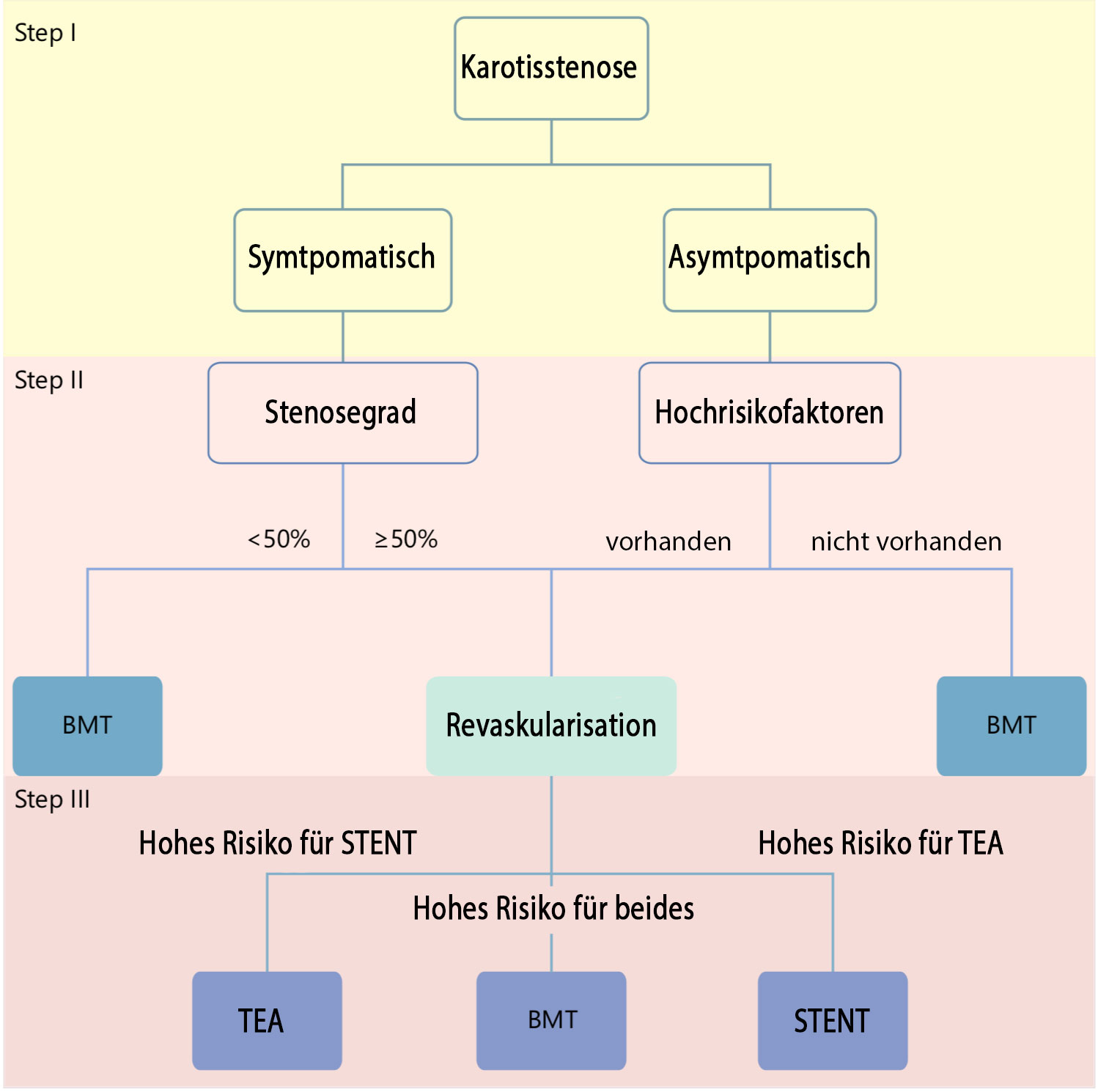
Die Therapieindikation richtet sich nach Symptomatik (asymptomatisch/symptomatisch) und Stenosegraduierung nach NASCET-Kriterien. Die Indikationsstellung sollte interdisziplinär erfolgen auf jeden Fall nach neurologischer Evaluation. Die dauerhafte Gabe eines Thrombozytenaggregationshemmers (ASS 100mg p.o.) ist zu empfehlen.
Noiphithak et. al. haben die Empfehlungen zur stadiengerechten Therapie der Carotisstenose entsprechend der aktuell gültigen Leitlinien von AWMF (2012), der American Heart Association (AHA) und der American Stroke Association (ASA) in einem für die Klinik gebräuchlichen Workflow verarbeitet (Noiphithak et. al. Cerebrovasc Dis 2017)
Operation
Gemäß der aktuellen Leitlinienempfehlungkannab einer 60%igen, asymptomatischenCarotisstenose die operative Desobliteration empfohlen werden. Dazu sollte das perioperative Schlaganfallrisiko unter 3% liegen. Dann ist eine signifikante Reduktion des Schlaganfall-Risikos gegenüber einer alleinigen konservativen Therapie zu erwarten. Ferner sollte der Patient/ die Patientin eine Lebenserwartung von über 5 Jahren haben. Weitere Kriterien zur Entscheidungsfindung (Hochrisiko-Stenose) ist der Abbildung zu entnehmen. Die Notwendigkeit der operativen Desobliteration einer asymptomatischen Carotisstenose ist Gegenstand ständiger Diskussion. In einigen Ländern wird keine Desobliteration einer asymptomatischen Carotisstenose durchgeführt.
Symptomatische Carotisstenosen sollten ab einem Stenosegrad von 50% operiert werden, das perioperative Schlaganfallrisiko sollte dabei unter 6% liegen.
Hochrisikofaktoren:
- Progression der Stenose
- Stattgehabte kontralaterale ischämische Attacke bzw. Schlaganfall
- Ungünstige Plaque-Konfiguration im Ultraschall
(Unregelmäßigkeiten, Ulzerationen etc.) - Einblutungen in den Plaque im MRT
- Mikroemboli im transkraniellen Doppler-Ultraschall
- Stumme Infarkte im CT
- Reduzierte cerebrovaskuläre Reserve
Die aktuelle S3-Leitlinie empfiehlt die Operation einer symptomatischen Carotisstenose (TIA oder nicht-behindernder Schlaganfall) so früh wie möglich, auf jeden Fall aber innerhalb der ersten 2 Wochen. Hintergrund ist die Theorie des aufgebrochenen Carotisplaques mit einer erhöhten Re-Embolisationsrate und konsekutiv erhöhtem Schlaganfallrisiko in dieser Zeit. Der ideale Zeitpunkt mit der niedrigsten periprozeduralen Komplikationsrate wird gegenwärtig zwischen dem 3. und 7. Tag gesehen. Der konkrete Operationszeitpunkt ist aber immer wieder Gegenstand aktueller Diskussion und Studien, einzelne neuere Untersuchungen zeigen mitunter keinen signifikanten Zusammenhang zwischen erhöhter Komplikationsrate und Zeitintervall nach Indexereignis und zeigen kein erhöhtes OP-Risiko für die sehr frühe sekundärpräventive Operation einer symptomatischen Carotisstenose (siehe auch Rappe et al.: „De ratione temporis- Einfluss der Zeit zwischen ischämie und Operation auf die Komplikationsrate bei Thrombendarteriektomie symptomatischer Carotisstenosen“ Gefäßchirurgie 7/16).
Bei Vorliegen einer Crescendo-TIA-Symptomatik (wiederholte Carotis-assoziierte TIAs in kürzer werdenden Zeitintervallen) sollte der Patient der notfallmäßigen Carotis-Operation zugeführt werden.
Im Falle des manifesten Schlaganfalls ist es generell aktuell akzeptiert, den stabilen Patienten bei rückläufiger neurologischer Symptomatik so früh wie möglich zu operieren. Hier können MRT-Untersuchungen wichtig sein, um intracranielle Schrankenstörungen oder (progrediente) nekrotische Einblutungen zu detektieren. Die Indikationsstellung sollte interdisziplinär erfolgen.
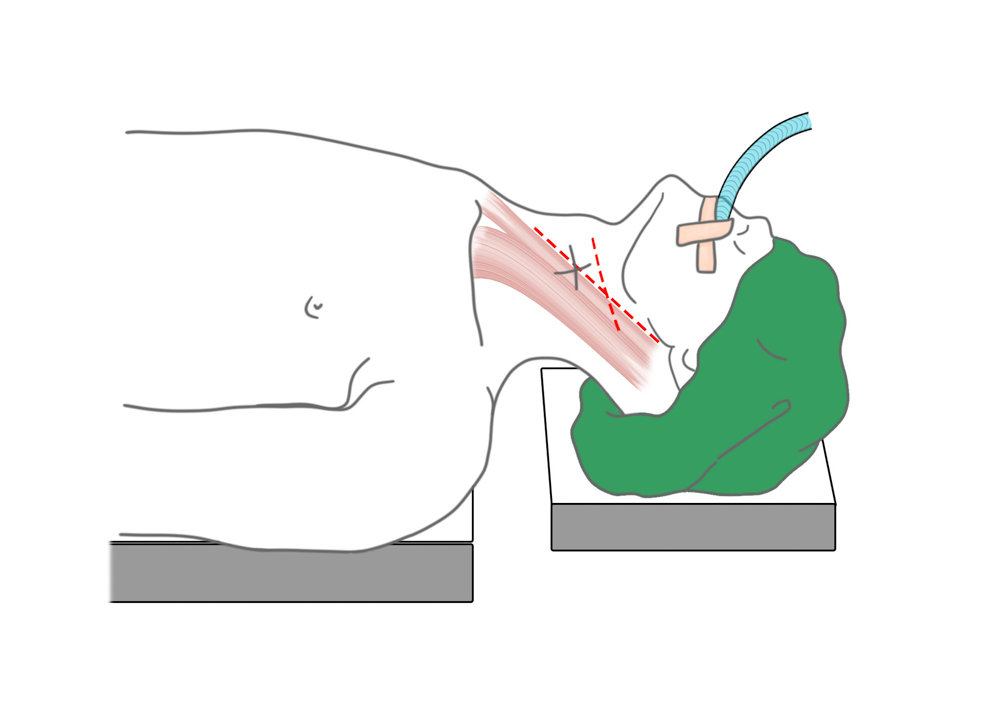
Lagerung zur Carotis-Operation
Als operative Therapieverfahren kommen die Thrombendarteriektomie (TEA, meistens mit boviner oder Dacron - Patchplastik) und die Eversionsendarteriektomie (EEA) der ACI in Betracht. Beide Eingriffe können in Intubationsnarkose oder Lokal-/Regionalanästhesie erfolgen. Der Eingriff erfolgt unter Thrombozytenaggregationshemmung.
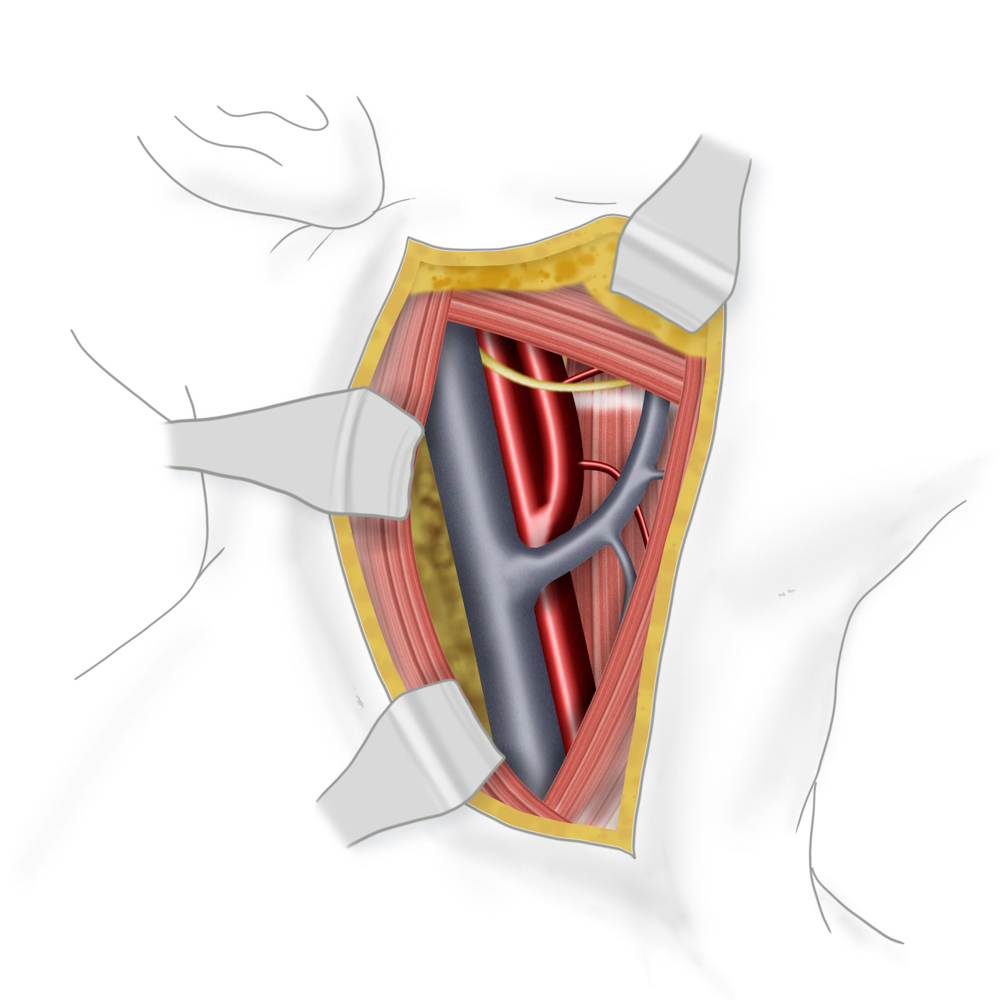
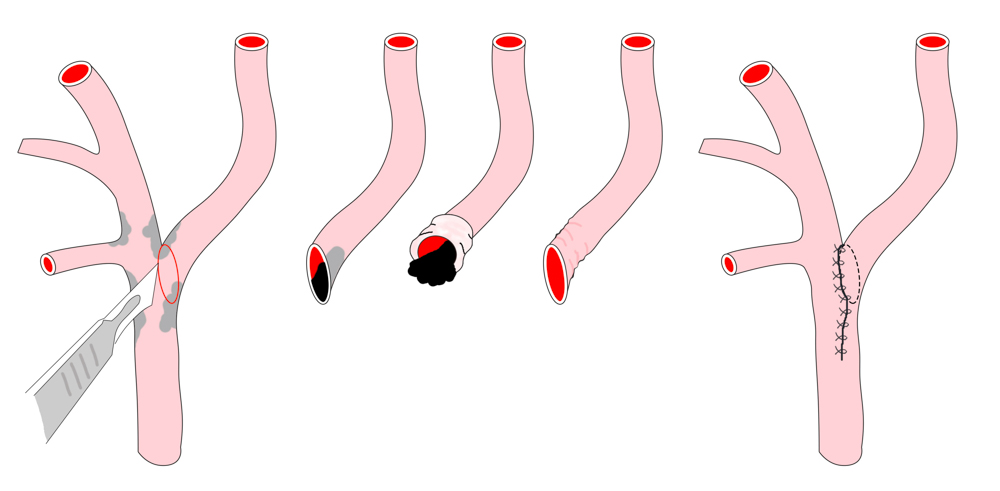
Nach Lagerung in der sog. Beach-chair-Position erfolgt die Schnittführung am Vorderrand des M. sternocleidomastoideus. Nach Präparation durch Unterhaut und Platysma wird die Carotisgabel im Trigonum caroticum freigelegt und A. carotis communis und externa angezügelt. Nach systemischer Heparingabe erfolgt das Ausklemmen der Gefäße in der Reihenfolge ACIàACCàACE.
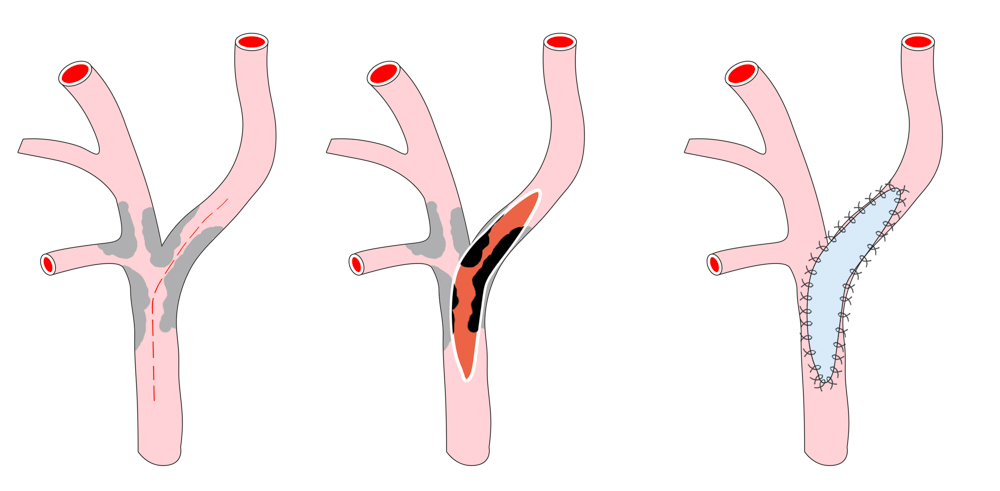
Bei der TEA erfolgt nun die longitudinale Vorderwandinzision von der Communis in die Interna hinein. Der Blutfluss zum Gehirn kann dabei zuvor durch Einlegen eines temporären arterio-arteriellen Shuntröhrchens (meistens Polyurethan) überbrückt werden, auch wenn hierfür bislang kein eindeutiger Vorteil gezeigt werden konnte. Nach stufenloser Ausschälung des Plaques wird meistens ein Dacron/Polyester- oder Rinderperikard-Flicken (z.B. Vascuguard) mit monofilem, nicht resorbierbarem Faden (Polypropylene 6-0) eingenäht. Dies ist aktuell in den meisten Kliniken Usus, wenn auch keine Verbesserung in Bezug auf das Langzeitergebnis im Vergleich zur Direktnaht der Gefäßwand besteht.
Im Rahmen der EEA erfolgt das Absetzen der Arteria carotis interna von der Carotisgabel. Das Gefäß wird „umgekrempelt“ (evertiert) und der Plaquezylinder unter Vermeidung einer Stufenbildung herausgezogen. Anschliessend kann das desobliterierte Gefäß mit monofilem, nicht resorbierbarem Faden (Polypropylene 6-0) zirkulär in die Gabel reinseriert werden.
Beide Verfahren sind als gleichwertig einzuordnen.
Im Rahmen der Operationsaufklärung ist der Patient neben allgemeinen Operationsrisiken (Nachblutung, Wundheilungsstörung, Infektion) insbesondere auf das intraoperative Schlaganfallrisiko, Verletzung nervaler Strukturen (N. hypoglossus mit ipsilateraler Zungendeviation, N. vagus, N. laryngeus recurrens mit Stimmbandparese und Heiserkeit, Ansa cervicalis profunda, Äste des Plexus parotideus nervi facialis etc.) sowie die Restenose und Patchektasie hinzuweisen.
Unter bestimmten Voraussetzungen (z.B. symptomatischer/hochgradiger Restenose, Z.n. Bestrahlung mit radiogener Stenose, hochzervikalen Stenosen, schwieriger Halsanatomie, Tandemstenosen mit intracranieller/intrathorakaler Stenose, kontralateraler N. laryngeus recurrens-Parese) kann die transfemorale Stentapplikation in die Carotis interna (CAS) eine Behandlungsindikation darstellen.
Die Wahl des Therapieverfahrens (TEA/EEA vs. CAS vs. medikamentöse Therapie) ist ebenfalls Gegenstand ständiger wissenschaftlicher Diskussion und aktueller Untersuchungen.
Die Nachbehandlung sollte aus der Einstellung der kardiovaskulären Risikofaktoren sowie der Verordnung eines Thrombozytenaggregationshemmers und eines Statins bestehen. Ferner sind regelmäßige duplexsonographische Kontrolluntersuchungen zu empfehlen.
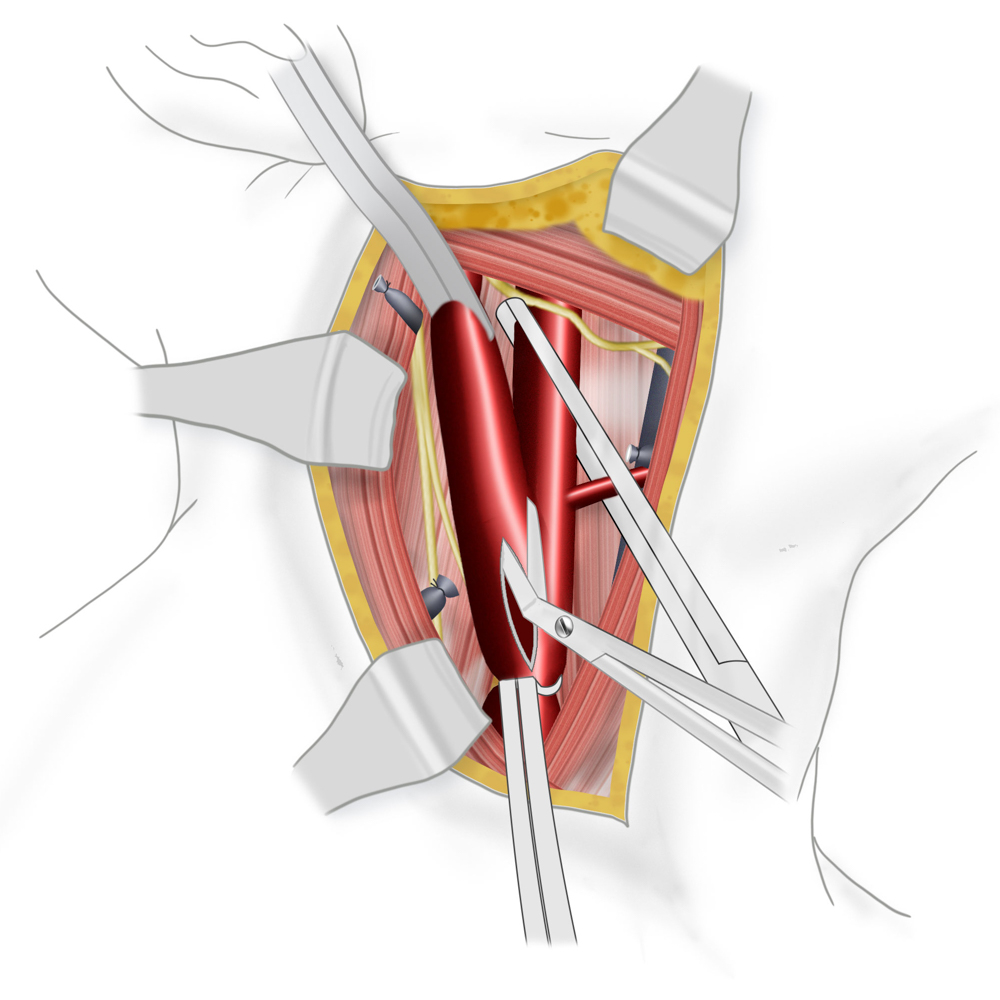
Eröffnung des ausgeklemmten Gefäßes
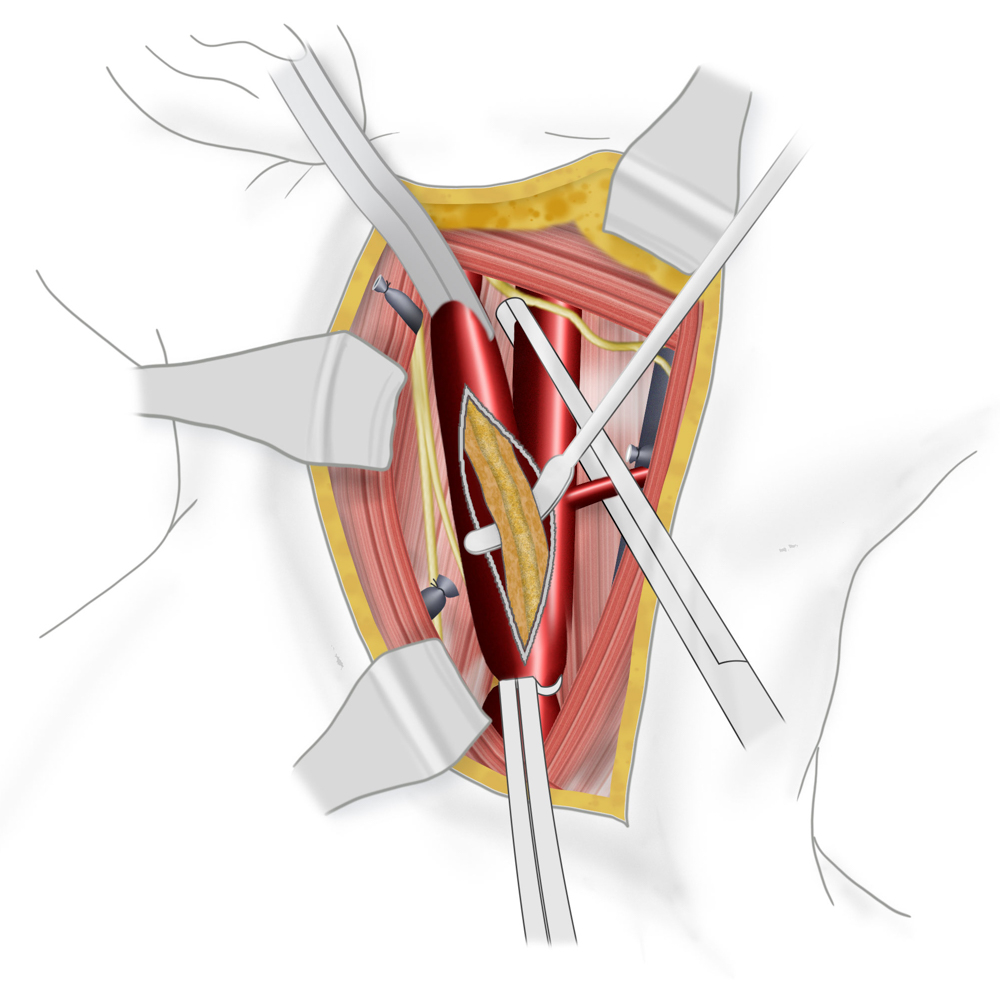
Auslösen des Plaques
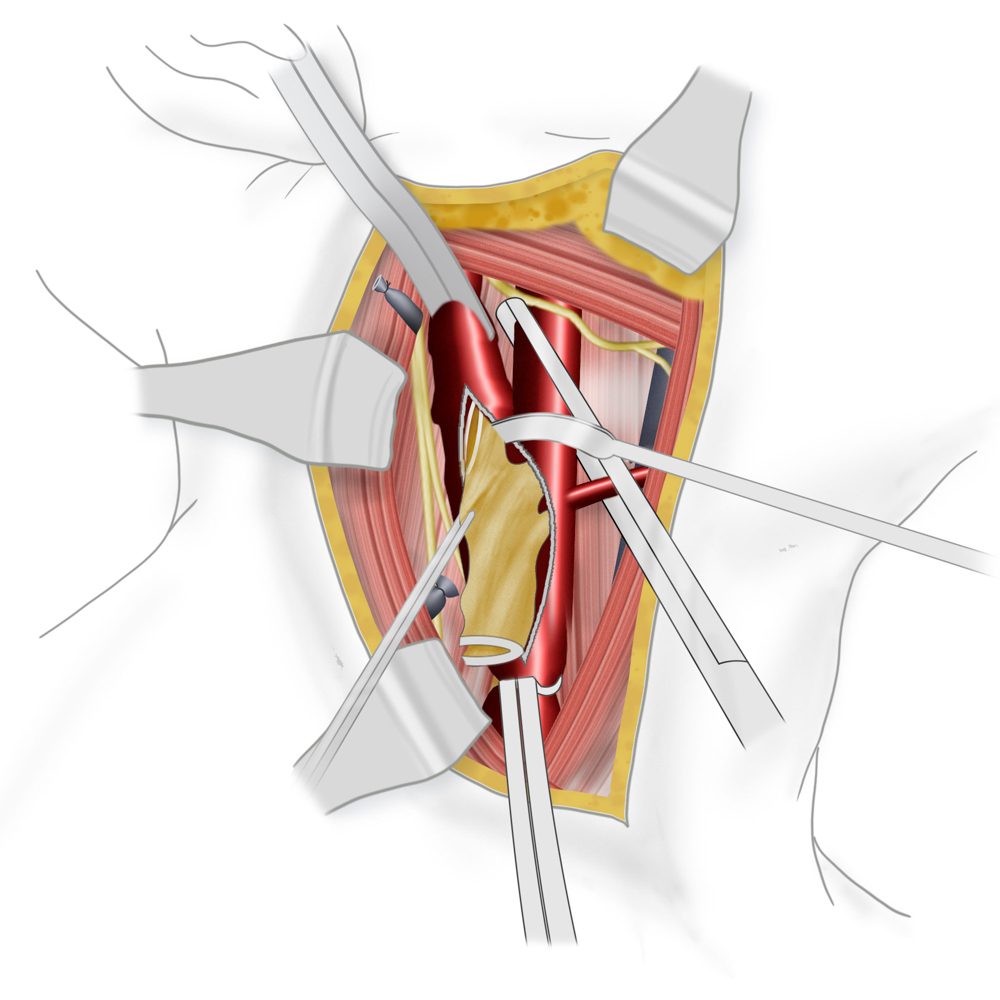
Auslösen des Plaques
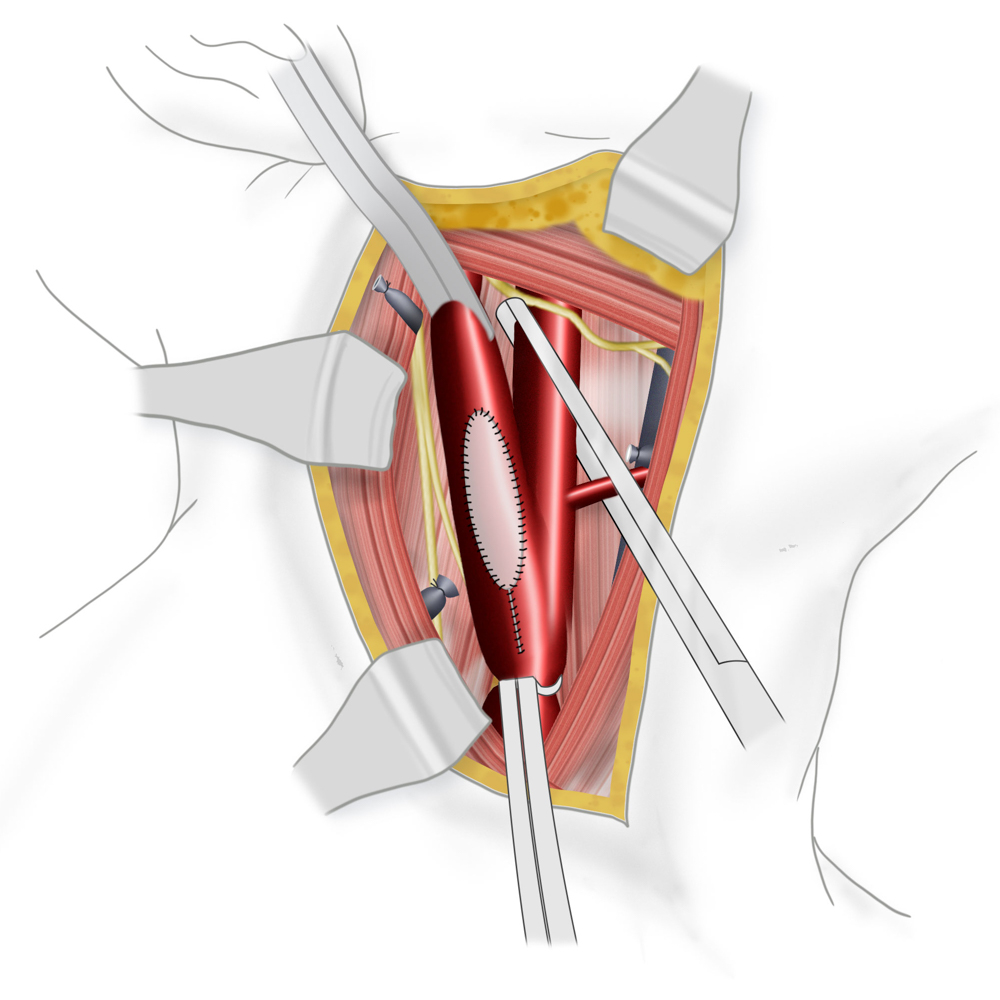
Verschluss des Gefäßes mit Dacron-Patch
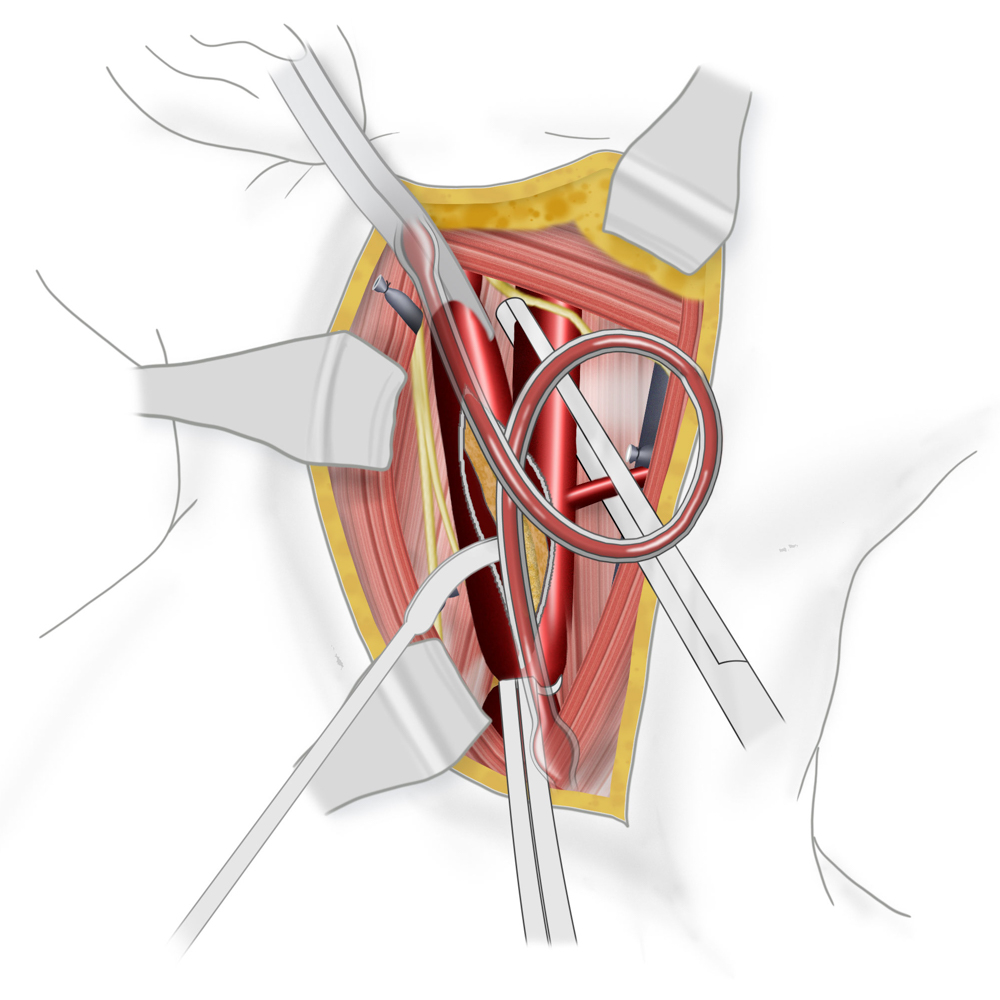
OP unter Verwendung eines Shunts
